Anne van der Does heeft bij het Laboratorium voor Respiratoire Celbiologie en Immunologie van de afdeling Longziekten van het LUMC een onderzoeksmodel op basis van een lung-on-chip ontwikkeld. Hiermee wil ze de complexe biologie onderzoeken achter de afweer van de long tegen infectie (‘host defence’), en daarbij vooral kijken naar het samenspel tussen het longepitheel en de daaronder liggende immuunen bloedvatcellen. Dat moet leiden tot meer inzicht in de verhoogde gevoeligheid voor infecties bij chronische longziekten, zoals COPD en astma, en uiteindelijk een betere behandeling ervan.
Onze longen worden dagelijks blootgesteld aan allerlei stofjes, bacteriën en virussen die het lichaam niet binnen wil hebben. De eerste verdedigingslinie bestaat uit verschillende lagen epitheelcellen. Die bevatten onder meer slijmproducerende cellen en trilhaarcellen, die het slijm (met daarin de ongewenste stoffen) kunnen wegduwen. Daarbij worden ze geholpen door lichaamseigen antibiotica in de vorm van antimicrobiële peptiden die door onder andere de epitheelcellen worden geproduceerd. Alles wat het afweersysteem van het epitheel doorlaat is prooi voor de immuuncellen, die via de onderliggende bloedvaten worden aangevoerd. Waar het longepitheel bij gezonde mensen een betrouwbare poortwachter is, kunnen patiënten met chronische longziekten, zoals COPD en astma, veel minder rekenen op deze verdedigingslinie.
Anne van der Does, post doc bij de afdeling Longziekten van het LUMC, heeft enkele jaren geleden al laten zien dat dit mede te maken heeft met de veranderende samenstelling van het epitheel bij chronische longziekten. “Veel patiënten met chronische longziekten krijgen in de loop der tijd meer slijmproducerende cellen en minder trilhaarcellen. Hierdoor blijft er veel meer slijm achter, wat kan leiden tot flinke hoestaanvallen bij dergelijke patiënten. Bijkomend effect van die veranderingen is dat er ook andere hoeveelheden antimicrobiële peptiden worden geproduceerd, wat een reden zou kunnen zijn waarom de patiënten gevoeliger zijn voor infecties.” Die gevoeligheid voor infecties zou ook kunnen samenhangen met een veranderende samenstelling van het microbioom, dat net als in de darmen ook in de longen aanwezig is, maar dan wel in veel lagere concentraties. Zo laag, dat het nog maar de vraag is of er in de longen een structurele rol voor het microbioom is weggelegd. Het zou ook kunnen dat de aanwezigheid hiervan vooral een consequentie is van het in- en uitademen van de bacteriën. “Je ziet echter wel vaak bij patiënten met longziekten dat de klaring van bacteriën en virussen niet goed werkt, en er daardoor meer achterblijft, meer kan uitgroeien en er ook veranderingen kunnen plaatsvinden in het microbioom.
Dat werpt weer nieuwe vragen op: Wat betekenen deze veranderingen? Welke verschillen zijn er te vinden in de samenstelling van het microbioom in rustfase (dus als er geen infectie is) en tijdens een infectie? Kan je bepaalde bacteriën beter onder controle houden, of gaat dat juist slechter als je een longziekte hebt? En wat zijn dan de gevolgen van die veranderingen voor het verloop van de ziekte? Worden microbioomveranderingen gedreven door de chronische ziekte, of beïnvloedt juist de veranderde samenstelling van het microbioom de gastheer, die daar weer anders op gaat reageren?”

Anne van der Does heeft bij het Laboratorium voor Respiratoire Celbiologie en Immunologie van de afdeling Longziekten van het LUMC een onderzoeksmodel op basis van een lung-onchip ontwikkeld. De apparaten staan in incubatoren van PHC Europe, die door een optimale warmteverdeling weer snel op de juiste temperatuur kunnen komen na openen van de deur.
Complexe weefselkweek
Om op dergelijke vragen een antwoord te vinden is het zaak om modellen te ontwikkelen waarbij je in één experiment naar meerdere celtypen kan kijken en uitspraken kan doen over de interactie tussen die cellen en in dit geval de bacteriën. “In ons onderzoek naar ‘host defence’, dat samen met longweefselherstel en longkanker de belangrijkste onderzoekslijn is binnen ons laboratorium, richten we ons niet alleen op het epitheel, wat feitelijk de luchtwegbelijning is. Maar er zijn nog meer cellen, bijvoorbeeld in de vorm van immuuncellen en daarnaast heb je onder het epitheel celtypes als fibroblasten en bloedvatcellen, die ook betrokken zijn bij de ontwikkeling en de progressie van chronische longziekten. Door dit complexe geheel te modelleren kan je ook uitspraken doen over de zogeheten cross-talk; hoe verschillende soorten cellen met elkaar communiceren”, legt Anne uit. In de zoektocht naar een geschikte combinatie van een organ-on-chip platform en een complex longcelkweekmodel is Anne uitgekomen bij het Amerikaanse bedrijf Emulate, dat zo’n vier jaar geleden is opgericht om de organ-onchip technologie, die is ontwikkeld bij het Wyss Institute for Biological Inspired Engineering van de Harvard universiteit in Boston te commercialiseren en door te ontwikkelen.
“In Boston waren ze al heel ver met complexe celkweek, waarbij je twee, drie of zelfs vier verschillende celtypes in één kweeksysteem kunt laten groeien, in eerste instantie voor de lever en darm. In het kader van een ‘global fellowship’, een tweejarige Marie Curie grant, heb ik in 2018 een jaar bij Emulate gewerkt om het chipmodel voor de long onder de knie te krijgen, waar ze inmiddels ook mee aan de slag waren gegaan.
Het jaar daarop zou ik dan in Leiden het protocol verder kunnen optimaliseren voor ons onderzoek, dat in eerste instantie is gericht op de hogere luchtwegen. Deze lung-onchip heeft twee kanalen: een voor de bloedvatcellen en een voor het luchtwegepitheel. In het midden overlappen de kanalen; dat is het gedeelte waar je de cross-talk hebt. Dergelijke constructies zijn op zich niet nieuw, want in ook door ons veel gebruikte transwell-systemen met een mandje in een plastic bakje, waarbij de cellen aan de ene kant worden blootgesteld aan de lucht en aan de onderkant in het medium hangen, is deze interactie mogelijk. Het grote voordeel van een organ-on-chip is echter dat het medium stroomt. Dat is vooral voor de bloedvatcellen biologisch van belang; ze reageren anders –natuurgetrouwer denken we– op het kweekmedium.
Hetzelfde gaat op voor de luchtstroom, die je in dit systeem ook kunt regelen. Een ander voordeel, dat specifiek geldt voor de lung-on-chip van Emulate, is dat het membraan, dat tussen de twee kanalen zit, rekbaar is. Door ‘stretch’ toe te passen kun je de effecten van de ademhaling op de cellen nabootsen. Dat is belangrijk voor een basaal begrip van de werking van de long, maar ook omdat de biomechanica van de long anders kan zijn bij longpatiënten, bijvoorbeeld omdat het weefsel stijver is. Dat membraan heeft daarnaast met een doorsnede van 7 micron veel grotere poriën dan bij normale celkweek, waar in het algemeen wordt gewerkt met 0,4 micron, zodat er alleen medium doorheen kan sijpelen. De 7 micron poriën laten ook immuuncellen door. Als de bloedcellen worden geactiveerd door signalen vanuit het luchtwegepitheel, begint het bloedvat met het tot expressie brengen van receptoren waaraan de immuuncellen blijven plakken. Zo kan je echte biologische processen nabootsen. Omdat je ook nog eens met humaan materiaal werkt, kan je met een long-on-chip een optimale vertaalslag maken naar de patiënt.”
Trampoline
Eenmaal terug in Nederland was het zaak om een robuust protocol voor de celkweek te ontwikkelen voor de cellen waarmee in het lab in Leiden wordt gewerkt. Dat lijkt eenvoudiger dan het is. “Je moet beseffen dat je op allemaal nieuwe materialen kweekt. Zo waren we hier gewend om met een stijf membraan met kleine poriën te werken. Als je dat vergelijkt met een stoeptegel, dan werken we nu met een trampoline. Hier reageren cellen heel anders op. We moesten dus alle protocollen waarmee we dagelijks werken, kritisch onder de loep nemen en opnieuw gaan uittesten. Dat geldt ook voor de protocollen voor het oogsten van de cellen en het uitlezen ervan; alles gaat net een beetje anders. We hebben het afgelopen jaar veel progressie geboekt, ondanks het feit dat je vaak maar één parameter tegelijk kunt veranderen. Als je bedenkt dat met een celkweek een kleine vier weken is gemoeid, kan je begrijpen dat we dat tweede jaar van mijn Marie Curie grant hard nodig hebben gehad om tot een solide protocol te komen. Dat is niet alleen voor ons zelf belangrijk, maar je hoopt dat je hiermee ook tot een standaard protocol bent gekomen waar ook andere onderzoekers mee uit de voeten kunnen”, vertelt Anne.
Geautomatiseerd
Het runnen van de lung-on-chip is verrassend eenvoudig. Het platform is in grote mate geautomatiseerd. Zodra je de van tevoren in een kweekfl es opgegroeide cellen aan het membraan en de wanden van de kanalen in de chip hebt gebonden, is het slechts een kwestie van het klikken van de carrier met de chip in de pod (een soort bakje) met het mediumreservoir. Die pod schuif je vervolgens in het apparaat en dan kan je maximaal twaalf chips (zes per tray) bij een geprogrammeerde flow rate en stretch (frequente en intensiteit) laten draaien. Om de temperatuur constant op 37 °C te houden, staan de apparaten in een incubator.
Anne heeft bewust gekozen voor incubatoren van PHC Europe. “De relatief grote apparaten, waarvan er twee in een incubator passen, beïnvloeden de luchtstroom in de incubator. Het voordeel van de PHC-incubatoren is dat de verwarming niet vanaf de zijkanten komt, maar meer rondom plaatsvindt. Daardoor heb je een betere warmteverdeling en duurt het minder lang voordat de incubator weer op de ingestelde temperatuur is nadat je de deur hebt geopend. Dat is met deze grote apparaten geen sinecure. Om die trays eruit te kunnen halen, moet je de deur van de incubator namelijk helemaal openen, zodat je best wel wat warmte verliest. Dat hebben we nu zo goed als mogelijk weten te minimaliseren.”

De apparaten voor de lung-on-chips staan geheel in de PHC-incubatoren. Ze worden van stroom voorzien door zogenaamde orb’s. Deze bollen zorgen ook voor de gewenste druk om het medium door de chip te drukken en het vacuüm voor het stretchen van het membraan.

De lung-on-chip, hier in de houder, is nog kleiner dan een USB-stick.
Jaren onderzoek
Na het afronden van de optimalisering van het protocol wil Anne van der Does in kaart brengen hoe het luchtwegepitheel zich ontwikkelt bij het stretchen van de cellen en het veranderen van parameters als airfl ow. “Die luchtlaag kunnen we ook besmetten met bacteriën, of blootstellen aan sigarettenrook, waarna we de effecten hiervan op bijvoorbeeld de immuunrespons kunnen bepalen. Zo hebben we talloze ideeën, voor jarenlang onderzoek. Bovendien zijn we bezig met het bouwen van een model voor de longblaasjes, want ook dieper in de longen vinden er allerlei processen plaats die bepalend zijn in chronische longziekten. Ook daar kunnen we met een lung-on-chip beter zicht op krijgen!”
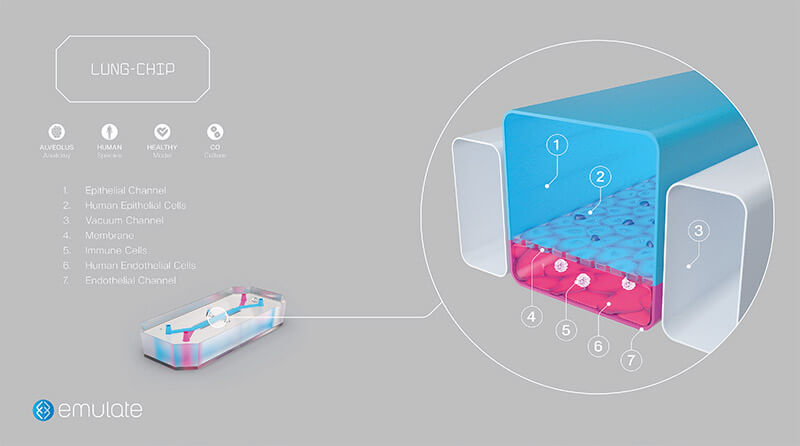
Configuratie van de lungon-chip (bron: Emulate).
Meer informatie:
PHC Europe
LUMC, afdeling Longziekten
Alternatief voor proefdiergebruik
Naast ethische redenen zijn er ook biologische redenen om vol in te zetten op het gebruik van lung-on-chip modellen. Longen van muizen verschillen wezenlijk van die van mensen, zowel anatomisch, biologisch (andere celtypen) als qua samenstelling van het microbioom. Ook zijn muizenlongen vatbaar voor heel andere bacteriën dan humane longen. Anne van der Does verwijst vaak naar een filmpje op www.proefdiervrij. nl, waarin duidelijk wordt gemaakt dat minder dan 10% van de in muizen ontwikkelde medicijnen de kliniek halen.
“De vertaalbaarheid naar de mens is echt wel een issue. Met organ-on-chip zijn we nog niet zo ver dat je er alle dierproeven mee kunt vervangen, maar we hopen dat we ze zeker wel sterk kunnen verminderen. Ook wordt er door anderen gewerkt aan nog complexere body-on-chip-modellen, waarbij je chips van verschillende organen met elkaar verbindt. Dan moet je wel een medium hebben waar de verschillende cellen in al die verschillende organen blij van worden;. En ook de timing met inzaaien is een uitdaging, want je wilt het liefst allemaal primaire cellen hebben.”

