Onderzoekers van de sectie Organische Chemie van de VU krijgen vanuit fundamentele kennis van 3D-structuren van eiwitten steeds meer vat op de werking ervan. Daarbij bouwen ze onder meer peptides in die zijn gesynthetiseerd uit niet-natuurlijke aminozuren. Sven Hennig, die sinds 2017 werkt bij de groep van Tom Grossmann, heeft voor de structuuranalyse een kristallografie X-ray faciliteit opgezet. Een essentiële zuiveringsstap –het vrijmaken van de eiwitten uit een E. coli expressiesysteem– gebeurt met een microfluidizer.
Hiermee kunnen betrouwbaar en snel de eiwitten worden vrijgemaakt uit de celsuspensie.
Hoe verandert de tertiaire en/of quaternaire structuur van eiwitten onder invloed van interacties die ze aangaan, en hoe kan je die interacties sturen of optimaliseren door de eiwitstructuur te modificeren? Dat is een notendop waar onderzoekers van Grossmann-groep, die onderdeel is van de sectie Organische Chemie van de VU, vat op proberen te krijgen in een breed scala aan eiwitten, die veelal betrokken zijn bij transcriptie- en regulatieprocessen. Universitair docent Sven Hennig (die samen met Tom Grossmann en vijf PhD’s, twee post-doc’s en vier master studenten de onderzoeksgroep vormt) legt uit hoe dergelijke onderzoeksprojecten verlopen.
“We gaan altijd uit van de kristalstructuur of een NMR-plaatje waardoor we precies de positie van ieder atoom in de structuur weten. De werking van een eiwit is in de regel gestoeld op de interactie met een ‘binding partner’, die plaatsvindt in een bepaald deel van het eiwit. Door deze binding partners na te bootsen en te moduleren, kunnen we het bindingsmechanisme beter begrijpen. Met die kennis kan je dan gericht modificaties aanbrengen in het eiwit, om een bepaald effect te optimaliseren of juist te remmen. Of de binding partner zodanig nabootsen dat die het beter doet dan de natuurlijke vorm. In dergelijke projecten vergaren we in eerste instantie vooral fundamentele kennis, maar die heeft al snel raakvlakken met toepassingen. Neem bijvoorbeeld een tumoreiwit. Als je de binding partners van dat eiwit kent, kan je structuren zodanig moduleren dat de interactie niet meer leidt tot een oncogeen effect. Zo kan ons werk de fundamentele basis vormen voor het zoeken naar geneesmiddelen die specifiek op dat eiwit aangrijpen.” Een klinische toepassing is echter nooit alleen het doel. “We zijn vooral geïnteresseerd in het begrijpen van de interactie om van daaruit met nieuwe ideeën te komen. We zijn niet zozeer op zoek naar moleculen die ergens voor kunnen worden toegepast, maar willen fundamentele kennis opdoen die ook toepasbaar is voor andere eiwit-interacties en -modulaties.

PhD-student Sebastian Kiehstaller maakt voor de eerste stap in het het opzuiveringsproces van eiwitten, die tot expressie zijn gebracht in E. coli, gebruik van de LM10 microfluidizer van Microfluidics, die is geleverd door Salm en Kipp. Hiermee kunnen betrouwbaar en snel de eiwitten worden vrijgemaakt uit de celsuspensie.

De LM10 microfluidizer van Microfluidics drukt een celsuspensie door een shearing cell, een keramische unit, die steeds nauwer wordt en op een gegeven moment de cel kapotmaakt. Vervolgens gaat het lysaat, met de eiwitten erin, door een gedeelte dat heel efficiënt koelt.
Peptidesynthese
Een belangrijk deel van het werk zit hem in de synthese van peptides. Die zijn vooral bedoeld om de stukjes eiwit na te bootsen die belangrijk zijn voor de interactie. Het is namelijk niet altijd even gemakkelijk om binding partners op de juiste plek te krijgen om eiwit-eiwit interacties te moduleren. Door een voor de interactie representatief stukje van circa tien aminozuren te gebruiken gaat dat een stuk gemakkelijker. En ook het moduleren (het veranderen van de structuur van het peptide om een betere binding partner of modulator voor de betreffende interactie te vinden) daarvan is relatief simpel met behulp van chemische synthese. Waar menigeen bij peptides zal denken aan een sequentie van enkele van de 22 natuurlijke aminozuren die in de cel voorkomen, is dat voor de VU-onderzoekers slechts het startpunt in hun synthesewerk. “Om dingen beter te kunnen begrijpen, moeten we meer diversificatie kunnen aanbrengen in de peptides. Hiervoor gebruiken we bijvoorbeeld peptides die niet in de natuur voorkomen, of peptides die met zichzelf kunnen binden, bijvoorbeeld door het sluiten van ringstructuren. Deze building blocks kunnen we zelf in het lab synthetiseren, maar omdat deze tak van sport sterk gegroeid is, kun je ze steeds vaker ook gewoon kopen”, vertelt Sven Hennig. Een aparte categorie wat dat betreft zijn de peptidomimetics, waarbij alle structuureigenschappen van een ‘wild type’ peptide ontbreken. Dit de-peptidiseren naar een totale ‘mimick’ van het peptide gaat zover dat het zelfs niet meer de oorspronkelijke backbone van het peptide bevat. Feitelijk is het dan een ‘small molecule’ dat een peptide nabootst.
Stabiliseren
Naast functionaliteit speelt ook de stabiliteit van de eiwitstructuren een belangrijke rol in het onderzoek. “Van nature zorgen bijvoorbeeld cysteïnes in de eiwitketen voor extra stabiliteit door het met elkaar aangaan van zwavelbruggen. Wil je echter niet-natuurlijke aminozuren in het eiwit incorporeren, dan is dat allemaal niet zo straightforward: bacteriële systemen zijn nog niet zo eenvoudig er toe aan te zetten om nietnatuurlijke aminozuren op te pakken en in het eiwit te stoppen. In onze groep zijn we derhalve op zoek gegaan naar andere manieren om de eiwitten te stabiliseren. We hebben ons daarbij gericht op het stabiliseren van de tertiaire structuur door gebruik van grotere cross-linkers. In deze ‘in situ cyclization of proteins’ (INCYPRO) benadering hebben we modulaire crosslinks in natieve eiwitten ingebouwd, die geheel bestaan uit proteïnogene aminozuren, dus de aminozuren die tijdens de translatie van de genetische code naar een polypeptide direct worden ingebouwd in de peptideketen. We zijn er in geslaagd om op drie plekken een chemische linker te koppelen met de cysteïne-residuen in het eiwit. Na reactie met een tris-electrofiel wordt er in-situ een cyclisatie gevormd. Die zorgt voor meer stabiliteit, wat we recent hebben aangetoond voor onder meer een sortase A, een enzym dat in protein engineering wordt gebruikt bij het in vitro post-translationeel modificeren van eiwitten. We kunnen nu dus standaard moleculair-biologische technieken gebruiken om genen te modificeren die coderen voor een eiwit met goed benaderbare cysteïnes”, legt Sven Hennig uit.
Vanwege de grotere stabiliteit van de structuur kan dit enzym een bepaalde reactie ook bij hogere temperaturen uitvoeren en is het beter bestand tegen detergenten als ureum. Dergelijke resultaten zijn niet alleen therapeutisch gezien interessant, omdat het eiwit beter om kan gaan met stressfactoren, maar ook vanuit biotechnologisch perspectief. “Bepaalde enzymen kunnen nu niet in grote installaties worden gebruikt omdat bijvoorbeeld de druk of de temperatuur te hoog is, of omdat er bepaalde organische oplosmiddelen worden gebruikt. We hebben nu de tools ontwikkeld om ook dergelijke eiwitten verder te stabiliseren, robuuster te maken, zodat ze op grote schaal kunnen worden toegepast in biotechnologische processen. Wat dat betreft gaat de wetmatigheid ‘if we loose structure, we loose activity’ hier ook op. De reden voor een lagere biologische activiteit kan liggen in het feit dat de structuur niet voldoet, instabiel is. Als we de structuur stabiliseren gaat dat beter, zien we bijvoorbeeld aan de hand van de smeltcurve.”

Universitair docent Sven Hennig, die sinds 2017 werkt bij de groep van Tom Grossmann, heeft voor de structuuranalyse van eiwitten een kristallografie X-ray faciliteit opgezet.
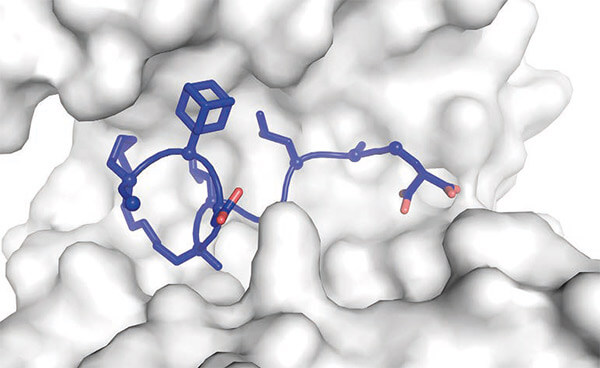
X-ray structuur(pdb-id: 5jm4) van een macrocyclisch peptide (blauw) met twee niet-natuurlijke aminozuren en een crosslinker die bindt aan zijn doeleiwit (wit, 14-3-3).
Bron: Structure-Based Design of Non-natural Macrocyclic Peptides That Inhibit Protein-Protein Interactions. Kruger, D.M., Glas, A., Bier, D., Pospiech, N., Wallraven, K., Dietrich, L., Ottmann, C., Koch, O., Hennig, S., Grossmann, T.N. (2017) J. Med. Chem. 60: 8982-8988.Zuiver eiwit
De ‘proof of the pudding’ bij het maken van al die nieuwe structuren is dat je ook daar weer mooie 3Dplaatjes van kan maken. Hiervoor heeft Sven Hennig, al snel nadat hij zich in 2017 bij de groep van Tom Grossman aansloot, op de afdeling een X-ray faciliteit met bijbehorende eiwitzuivering opgezet die speciaal gericht is op kristallografie van eiwitten en koolstofgebaseerde small molecules. Een faciliteit die niet alleen voor de groep Organische Chemie bedoeld is, maar ook kan worden ingezet voor collega-onderzoekers binnen het AIMMS (Amsterdam Institute for Molecules, Medicines and Systems) dat in het O2-gebouw is gevestigd. Een van de onderzoekers die veel werkt met de X-ray faciliteit is PhD-student Sebastian Kiehstaller, die het eerste half jaar van zijn promotieonderzoek onder supervisie van Sven Hennig aan de Universiteit van Dortmund verrichte om vervolgens in 2017 ook naar Amsterdam te verhuizen.
“ Biochemici zijn gewend om alles goed schoon te maken.
Net als bij koken: iemand moet de afwas doen!”
“De praktijkervaring die we in Dortmund met kristallografie van eiwitten hebben opgedaan kwam ons aan de VU goed van pas bij het opzetten van de X-ray faciliteit en –niet onbelangrijk– de bijbehorende eiwitzuivering. Voor de meeste projecten is het namelijk nodig om eiwitten te zuiveren, die tot expressie zijn gebracht in E. coli. De eerste stap is dan het eiwit uit de cellen zien te krijgen. Hiervoor gebruiken we de LM10 microfluidizer van Microfluidics, die is geleverd door Salm en Kipp. Dit type apparaat, dat we ook al naar volle tevredenheid in Dortmund gebruikten, drukt een celsuspensie door een shearing cell, een keramische unit, die steeds nauwer wordt en op een gegeven moment de cel kapotmaakt. Vervolgens gaat het lysaat met de eiwitten erin door een gedeelte dat heel efficiënt koelt, wat essentieel is. Er wordt namelijk veel hitte gegenereerd bij dit proces, dat onder hoge druk plaatsvindt en eiwitten kunnen daar niet zo goed tegen. We hebben deze methode verkozen boven het sonificeren, dat aanvankelijk bij deze groep werd toegepast. Dat bracht voor onze experimenten een te grote batch-to-batch variatie met zich mee en was derhalve niet efficiënt genoeg. De microfluidizer is een zeer robuust apparaat, betrouwbaar en snel en gemakkelijk te gebruiken. Ook schoonmaken is geen probleem: gewoon water (of soms een isopropanol mengsel) gebruiken in plaats van de celsuspensie”, aldus Sebastian Kiehstaller.
Mooie eiwitkristallen
Na verdere zuivering door centrifugeren (om van onder andere onoplosbare membraanfragmenten en celresten af te komen) en, afhankelijk van hoe lastig de scheiding is, één of meerdere stappen met affiniteitschromatografie of SEC, heb je het zuivere eiwit in een oplossing. Dan ben je er nog niet, want voor X-ray kristallografie moet je een semivaste toestand van het eiwit hebben, dus moet je nog van het grootste deel van je oplossing zien af te komen. Dat gedeelte is volgens Sven Hennig misschien nog wel lastiger dan het X-ray gebeuren zelf. “Er gaat veel tijd in zitten om tot goede kristallen te komen. Hiervoor gebruiken we een techniek die is gebaseerd op dampdiffusie. We verdelen hiervoor het eiwit over een 96-wells plaat, waarbij ieder welletje gevuld is met een verschillend samengestelde buffer. Met deze platen met pre-made screening conditions, die je kant-en-klaar kunt bestellen, kan je heel efficiënt via trial-and-error tot de beste condities voor het betreffende eiwit komen. Door de welletjes luchtdicht af te sluiten en een vacuüm aan te brengen zet je het proces van dampdiffusie uit het druppeltje, dat in eerste instantie 200 nl groot is, in het reservoir op de bodem van het welletje in werking. Zo verhoog je de concentratie van het eiwit en forceer je het eiwit om neer te slaan. In het optimale geval zal hierbij een kristal worden gevormd en kan je met de X-ray aan de slag en de structuur oplossen.
Heb je voor een bepaald eiwit de omstandigheden geoptimaliseerd, dan kan je ook met grotere eiwithoeveelheden werken. We proberen in een run namelijk zoveel mogelijk eiwit te maken, omdat het groeien van cellen best veel tijd kost. Ook wat dat betreft is de microfluidizer van waarde: het maakt namelijk helemaal niets uit of die veel of weinig celsuspensie moet verwerken. Je zet hem aan en hij doet gewoon zijn werk!”
Meer informatie:
Salm en Kipp
Grossmann groep
www.grossmannlab.de

